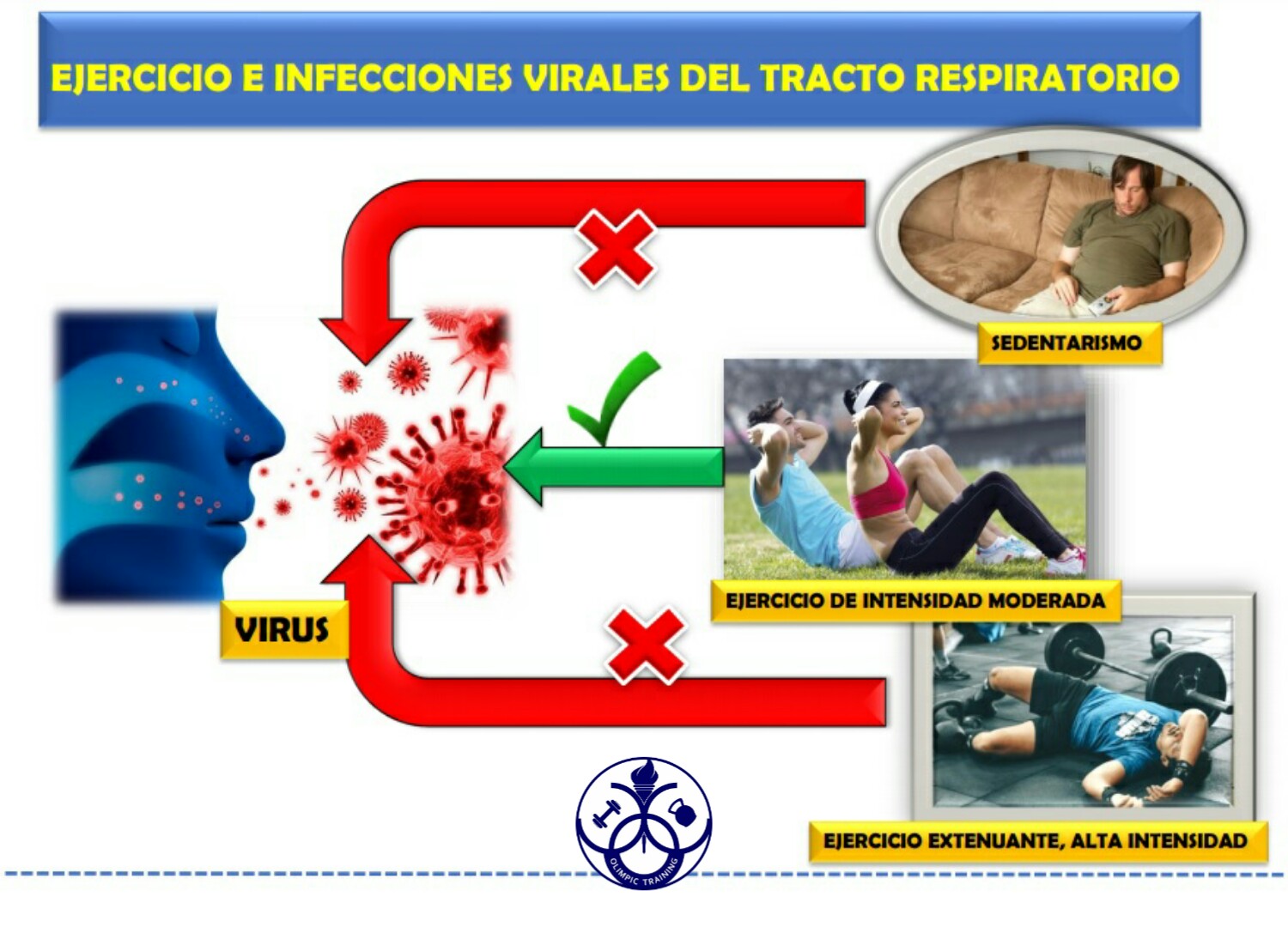
El ejercicio intenso prolongado causa inmunosupresión, mientras que el ejercicio de intensidad moderada mejora la función inmune y potencialmente reduce el riesgo y la gravedad de la infección viral respiratoria. En esta publicación daremos a conocer los principales mecanismos que son activados con el ejercicio en las hormonas del estrés que reducen la inflamación local excesiva y desvían la respuesta inmune de un fenotipo Th1 hacia un fenotipo Th2, mejorando así los resultados después de la infección viral respiratoria.
Infecciones virales
Las infecciones virales respiratorias representan la forma más prevalente y patógena de enfermedad infecciosa, representando más del 7% de todas las muertes tanto en hombres como en mujeres en 2004 (Mathers C & cols, 2008).
La infección ocurre cuando un huésped entra en contacto con gotitas de aerosol infectadas o superficies contaminadas, después de lo cual el virus invade e infecta los tejidos de la mucosa respiratoria superior y / o inferior del huésped. La duración de la enfermedad suele durar de 7 a 14 días, y los síntomas habituales incluyen: tos, congestión nasal, fiebre, dolores corporales, malestar y, en casos graves, la muerte.
¿Cómo funciona tu sistema inmune?
Los virus respiratorios se unen a las glucoproteínas en la superficie de las células epiteliales de la mucosa, lo que induce endocitosis mediada por receptores e infección posterior de la célula huésped. En individuos inmunizados, las inmunoglobulinas salivales y de la mucosa, principalmente IgA, reconocen y se unen a los epítopos virales, bloqueando su entrada en las células de la mucosa y reduciendo la susceptibilidad a la infección secundaria. La invasión del virus de la mucosa respiratoria evoca una respuesta inmune innata a través de la unión de patrones moleculares asociados a patógenos (PAMP) a las moléculas del receptor tipo toll (TLR) en los macrófagos pulmonares (Mϕ), las células dendríticas mieloides (mDC) y las dendríticas plasmacitoides. células (pDC). Se activan los interferones INFa-b, lo cual ayuda a mantener a la célula viral fuera de las células respiratorias internas.
Además de inducir la actividad anti viral en las células huésped, las células inmunes innatas activadas también secretan numerosas citocinas pro inflamatorias que incluyen: interleucina (IL) -1, IL-6, IL-12 y factor de necrosis tumoral (TNF) -α que inducen un efecto local. y la respuesta inflamatoria sistémica caracterizada por una mayor producción de proteínas del complemento opsonizante de fase aguda, una mayor extravasación de leucocitos a los tejidos infectados y una mayor presentación de antígenos y capacidad citotóxica.
De particular importancia es la IL-12, que cierra la brecha entre la inmunidad innata y la adaptativa al conducir la diferenciación de las células T cooperadoras vivas (Th0 ) hacia un fenotipo Th1 caracterizado por la producción de citocinas pro inflamatorias IL-2 e IFN-γ. La IL-2 secretada por Th1 promueve la maduración de los linfocitos T citotóxicos específicos de antígeno (células T CD8 + ) que reconocen los antígenos virales en las células infectadas a través de la asociación de las interacciones principales del complejo de histocompatibilidad (MHC) I con los receptores de células T (TCR). La activación de CD8 + TCR induce la muerte citotóxica de células infectadas por virus, CD8 +proliferación celular, producción de citocinas anti virales como IFN-γ y muerte celular inducida por activación (AICD). Esto activa la labor de las células Natural Killer (NK), que inducen la apoptosis de las células infectadas.
¿Esta defensa es suficiente?
Es necesaria una fuerte respuesta Th1 en las primeras etapas de la infección viral, ya que promueve la eliminación rápida del virus. Sin embargo, la actividad prolongada de Th1 puede conducir a una patología del tejido respiratorio, a través del aumento del daño celular y la necrosis (Van Reeth K, 2000). Los mecanismos inmunorreguladores intentan prevenir la patología inducida por Th1 desplazando el fenotipo de la célula Th hacia Th2, caracterizado por la secreción de proteínas anti inflamatorias IL-4 e IL-10. Esta última actúa para inhibir el efecto de las citocinas pro inflamatorias, mientras que IL-4 estimula a las células B vírgenes a aumentar de tamaño y aumentar la síntesis de moléculas de MHC II importantes para la presentación del antígeno. La activación del antígeno del receptor de células B, junto con la coactivación por las células Th2 hace que las células B se diferencien en células B de plasma y memoria. Las células plasmáticas secretan grandes cantidades de anticuerpos anti virales, particularmente IgA, que se une a los epítopos virales para evitar la entrada viral en las células no infectadas. La unión de anticuerpos de las células infectadas también induce citotoxicidad mediada por células dependientes de anticuerpos (ADCC) de células asesinas naturales (NK) y activación de la proteína del complemento, lo que conduce a la apoptosis de las células infectadas. En resumen, los mecanismos inmunes innatos (por ejemplo , los IFN) mantienen la replicación viral y se propagan bajo control hasta que las respuestas inmunes adaptativas (principalmente células T CD8 + citotóxicas) eliminan la infección; un proceso que tiene lugar dentro de los 7 a 14 días. La infección primaria conduce al desarrollo de respuestas inmunes adaptativas caracterizadas por anticuerpos específicos que evitan la unión viral posterior y las células T de memoria que responden con mayor vigor en la exposición secundaria.
8) Las células apoptóticas se fagocitan por Mφ, pDC y células dendríticas mieloides (mDC) y el antígeno intracelular se presenta de forma cruzada a las células T citotóxicas . Para contra-regular el inflamatoria Th 1 de respuesta, las células Th0 vírgenes se diferencian en
9) Th 2 células que segregan citoquinas antiinflamatorias IL-10 e IL-4.
10) IL-10 regula la respuesta de fase aguda, mientras que IL-4 promueve la diferenciación de células B en linfocitos B de plasma y memoria.
11) Las células B plasmáticas secretan anticuerpos, particularmente IgA, que bloquean la entrada viral y opsonizan las células infectadas para la citotoxicidad celular dependiente de anticuerpos.
1) Los virus respiratorios invaden las células epiteliales de la mucosa respiratoria y las células inmunes innatas residenciales, donde activan los receptores TLR e inducen la respuesta inmune innata.
2) Los macrófagos activados (Mφ) y las células dendríticas plasmocitoides (pDC) producen IFN-α / β, que impide la replicación viral en las células huésped
3) Además, los macrófagos secretan citocinas pro inflamatorias (IL-6, TNF-α e IL- 1) que estimulan la respuesta inflamatoria de fase aguda.
4) La secreción de IL-12 por pDC diferencia las células T cooperadoras (Th0) vírgenes en
5) células Th 1 , que secretan IL-2 e IFN-γ.
6) IL-2 promueve la maduración de T citotóxico células, que reconocen el antígeno presentado a través de MHC 1 en células infectadas, y promueven la apoptosis.
Ejercicio e infección viral
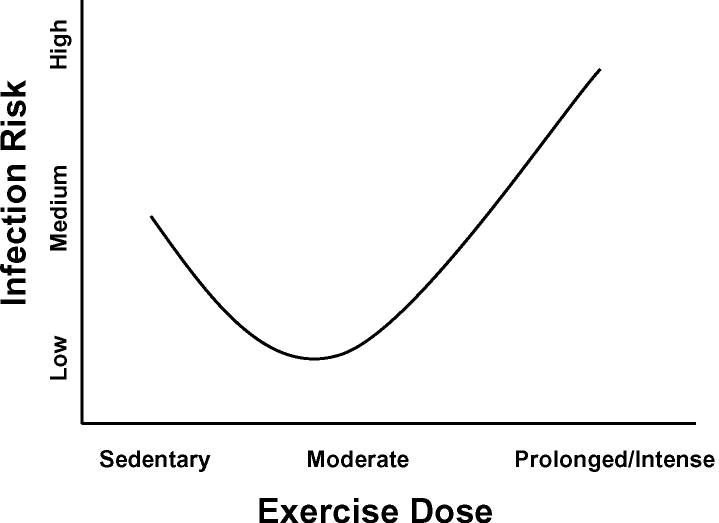
Los datos transversales y longitudinales sugieren que las personas que realizan ejercicio regular de intensidad moderada mantienen un riesgo reducido de síntomas respiratorios auto informados. Además se demuestra que el ejercicio de intensidad moderada antes de la infección o los síntomas infecciosos reduce la mortalidad asociada al virus (Martin et al, 2010). Si bien la mayoría de los estudios moleculares se han realizado en ratas, existe una gran correlación con el actuar inmunitario del cuerpo humano. En contraste, el ejercicio intenso antes o durante la infección viral se ha asociado con una mayor morbilidad y mortalidad. Estos hallazgos han dado lugar a la hipótesis de ‘forma de J’, relacionando la dosis de ejercicio con el riesgo de infección.
Episodios infecciosos en corredores antes y después de una carrera.
J Sports Med Phys Fitness .
1989
Modelo en «J» que representa el efecto dependiente de la dosis del ejercicio sobre el riesgo y la gravedad de las infecciones del tracto respiratorio. Se considera que las personas sedentarias tienen un riesgo normal de URTI. El ejercicio de baja o moderada intensidad o frecuencia se asocia con un menor riesgo de URTI. Mientras que el ejercicio de alta intensidad se asocia con un mayor riesgo de infección
Pruebas de laboratorio
Ratones inoculados con el virus del herpes simple 1 (HSV-1) 15 minutos después de un solo episodio de ejercicio de 30 minutos de intensidad moderada o de alta intensidad en la caminadora corriendo a fatiga volitiva. Los ratones sedentarios sirvieron como controles y todos los ratones permanecieron en sus jaulas domésticas durante 21 días después de la infección. A los 21 días, el 41% de los ratones que se ejercitaron hasta la fatiga habían muerto; significativamente mayor que la tasa de mortalidad del 16% experimentada por el grupo de control. No hubo diferencia estadística en la tasa de mortalidad entre el control y el grupo de ejercicio moderado (9% de mortalidad a los 21 días). Estos resultados demostraron que una sola sesión de ejercicio intenso puede causar serias deficiencias en la defensa inmune cuando se contrae una infección viral potencialmente letal. Los estudios de seguimiento han confirmado este hallazgo (Browns & cols, 2004), aunque un estudio también indicó que el ejercicio moderado a corto plazo antes de la infección en ratones puede proteger contra la mortalidad asociada a la infección viral (Davis et al, 2004).
Más tarde se realizó un estudio que probó los efectos del ejercicio sobre la infección por el virus de la gripe. Cepa común de influenza de laboratorio A / Puerto Rico / 8/34 en una dosis diseñada para inducir aproximadamente el 50% de mortalidad en ratones de control sedentario. Cuatro horas después de la infección, los ratones comenzaron un programa de ejercicio de 4 días de 30 min. (moderados) o 150 min. (intensos) al día. El programa de ejercicios finalizó después del día 4 cuando los ratones comenzaron a mostrar síntomas (por ejemplo , letargo, reducción de la construcción de nidos) de infección. Descubrimos que los ratones asignados a ejercicio moderado tenían tasas de mortalidad significativamente más bajas que el grupo control que no hacía ejercicio (18% frente a 56% de mortalidad, respectivamente) después de 25 días. Los ratones en el grupo de ejercicio prolongado no tuvieron una tasa de mortalidad estadísticamente diferente que los controles; aunque el ejercicio prolongado resultó en un mayor porcentaje de mortalidad que los controles (70% versus 56% de mortalidad, respectivamente). De hecho, recientemente se ha establecido el efecto perjudicial del ejercicio intenso y prolongado sobre la mortalidad debida al virus de la influenza. Los ratones en el grupo de ejercicio intenso y prolongado también tuvieron una mayor puntuación de morbilidad compuesta asociada a la influenza (medida por la actividad física observada, la respuesta al manejo y la apariencia física) antes de la muerte que sus contrapartes de control y ejercicio moderado. Este estudio fue el primero en indicar que el ejercicio moderado iniciado después de la infección pero antes del inicio de los síntomas puede tener un efecto beneficioso sobre la susceptibilidad a un verdadero patógeno respiratorio humano. Es importante tener en cuenta que la dosis a la que se administró el virus de la influenza indujo una infección del tracto respiratorio inferior.
Brain Behav Immun . 2005
Influencia del ejercicio sobre la mortalidad por influenza (H1N1 Puerto Rico A / 8/34) en ratones Balb / c machos de 20-24 semanas de edad. La supervivencia media fue de 14 ± 1, 17 ± 2 y 16 ± 3 días para el control, ejercicio moderado y prolongado, respectivamente. Hubo una diferencia estadísticamente significativa entre el control y el ejercicio moderado (rango logarítmico = 7.3; p = 0.007), pero no entre el control y el ejercicio prolongado (rango logarítmico = 1.1; p = 0.29).
Se realizó un experimento adicional para definir posibles mecanismos a través de los cuales el ejercicio mejora la supervivencia en este modelo de virus de la influenza, usando el ejercicio idéntico y el modelo de infección de influenza descrito anteriormente. Se analiza la infiltración celular en los pulmones, el bazo y el drenaje de los ganglios linfáticos mediastínicos y la expresión de genes y proteínas de citocinas en varios puntos temporales después de la infección. Se presume que el entrenamiento físico promovería un cambio anti inflamatorio de un fenotipo dominado por Th1 hacia una respuesta inmune de tipo Th2; sin abrogar totalmente la inmunidad mediada por Th1. Las respuestas inmunes inflamatorias Th1 inducen una regulación positiva de las citocinas pro inflamatorias, particularmente IFN-γ, que inicia una mejor presentación del antígeno Mϕ y una mayor actividad fagocitótica / citotóxica. Una respuesta Th1 suficiente es esencial para la actividad anti viral temprana y promueve una vigilancia inmune elevada, un aclaramiento viral mejorado y respuestas de memoria. Paralelamente a la reducción de muchas (pero no todas) las citocinas Th1, observamos un cambio hacia el perfil de citocinas antiinflamatorias de tipo Th2. Los niveles de proteína pulmonar de IL-4 fueron 2 veces mayores para los ratones en ejercicio en comparación con los ratones sedentarios 3 días después de la infección. IL-4 promueve la diferenciación de células Th vírgenes a un fenotipo Th2, que luego coestimula las células B, iniciando la producción de anticuerpos neutralizantes de virus. Los anticuerpos virales reducen la carga viral al inhibir la infección de células no infectadas y opsonizar las células infectadas con virus para ADCC. Apoyando aún más la hipótesis anti inflamatoria, el ejercicio aumentó el receptor soluble de TNF-α (sTNFrII), que se une al TNF-α circulante, evitando la unión a la membrana y la posterior activación de las vías de señalización de NF-κβ. Además de la expresión elevada de citocinas de tipo Th2. En resumen, encontramos que el ejercicio de intensidad moderada después de la infección por influenza redujo la inflamación pulmonar al inducir un cambio de la respuesta inflamatoria tipo Th1 a una respuesta anti inflamatoria tipo Th2 y esto se asoció con una reducción en la morbilidad y mortalidad.
Con base en nuestros datos, nuestra hipótesis actual mantiene que el ejercicio moderado provoca un cambio sutil desde Th1 hacia una respuesta Th2, mejorando la recuperación y mejorando las tasas de supervivencia en casos donde la carga viral y el riesgo de morbilidad / mortalidad es alto. En estas condiciones, una respuesta inflamatoria exagerada a la alta carga viral contribuye a la patología observada en el pulmón y, en última instancia, al aumento de la morbilidad y la mortalidad. Sin embargo, parece haber un punto de retorno decreciente; Como el ejercicio intenso y prolongado conduce a la supresión de la inflamación y a la reducción de las funciones efectoras antivirales críticas, incluidas las de las células alveolares Mϕ y quizás las células NK resultando en una mayor morbilidad y mortalidad.
Modelo hipotético que describe el efecto dosis-respuesta del ejercicio sobre las respuestas inmunes Th1 y Th2 a la infección viral respiratoria. El ejercicio moderado aumenta de manera transitoria los glucocorticoides, las catecolaminas y la IL-6 a niveles moderados, lo que resulta en un sesgo sutil lejos de Th1 y hacia Th2 sin afectar o aumentar las funciones clave de las células efectoras y permitir el desarrollo de una respuesta inmune adaptativa adecuada. Por el contrario, el ejercicio intenso y prolongado da como resultado un aumento mayor y más duradero de los glucocorticoides, las catecolaminas y la IL-6, lo que resulta en un sesgo severo desde Th1 hacia Th2, disminución de la función de las células efectoras y la incapacidad para desarrollar respuestas inmunes adaptativas apropiadas.
En Conclusión
Este artículo ha proporcionado evidencia para apoyar la hipótesis de que el ejercicio de intensidad moderada reduce la inflamación y mejora la respuesta inmune a las infecciones virales respiratorias. Presumimos que el ejercicio moderado agudo y crónico induce un nivel de hormonas del estrés que regula a la baja la inflamación excesiva dentro del tracto respiratorio y ayuda a activar la inmunidad anti viral innata desplazando la respuesta inmune hacia un perfil Th2, equilibrando así las respuestas Th1 / Th2 para evitar una reacción inmune Th1 excesiva a estos patógenos.
El ejercicio prolongado e intenso también puede hacer esto, pero puede cambiar demasiado el equilibrio hacia Th2 y alejarse de Th1, lo que realmente permite que el virus gane una mejor posición y cause una mayor patología. Se necesita más investigación para examinar los mecanismos celulares y moleculares a través de los cuales el ejercicio modula la función inmune. Además, los estudios en humanos deberían intentar dilucidar los patógenos respiratorios más comunes responsables de las infecciones asociadas con el entrenamiento físico de alta intensidad y las competencias deportivas, y los métodos que emplean para evadir la respuesta inmune, así como intentar traducir los estudios mecanicistas a un modelo experimental humano.
Referencias:
- Stephen A. Martin, Brandt D. Pence, Jeffrey A. Woods. Exercise and Respiratory Tract Viral Infections. Exerc. Sport Sci. Rev., Vol. 37, No. 4, pp. 157Y164, 2009.
- Mathers C, Fat DM, Boerma JT, Organización Mundial de la Salud. La carga mundial de la enfermedad: actualización de 2004. Organización Mundial de la Salud; Ginebra, Suiza: 2008. p. vii.p. 146.
- Van Reeth K. Citoquinas en la patogénesis de la gripe. Veterinario Microbiol. 2000; 74 (1–2): 109–16.
Adjunto el archivo original del estudio utilizado para realizar esta publicación: